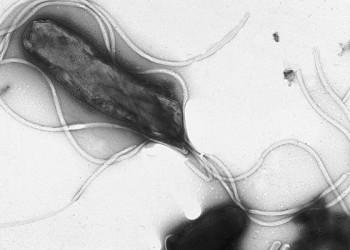
Helicobacter pylori este un bacil Gram negativ spiralat (în formă de helix – de unde și numele), flagelat și mobil. Izolarea sa la nivelul mucoasei gastrice din anii 1980 a revoluționat diagnosticul și tratamentul bolilor gastroduodenale.
Astfel, dacă în trecut boala ulceroasă era definită printr-un dezechilibru între factorii protectori şi agresori ai mucoasei gastroduodenale, actualmente este considerată o boală infecţioasă, în care eradicarea agentului cauzal duce la vindecare. HP este implicat şi în alte afecţiuni ale tractului digestiv superior, inclusiv în cancerul gastric (ADK, limfom gastric). Diagnosticul infecţiei cu HP se face fie prin metode invazive (testul bioptic al ureazei, testul histologic, cultura HP), fie prin metode neinvazive (determinarea anticorpilor anti-HP, testul respirator cu uree). Tratamentul anti-HP se indică în caz de gastrită cronică HP (+), ulcer gastric sau duodenal HP (+), limfom MALT şi la persoanele cu antecendente heredocolaterale de cancer gastric.
Date epidemiologice
Prevalenţa infecţiei cu HP variază mult de la o ţară la alta, în funcţie de statusul socio-economic: astfel, în ţările în curs de dezvoltare prevalenţa la adulţii de vârstă mijlocie este de peste 80%, pe când în ţările dezvoltate este de doar 20-50%. Prevalenţa creşte odată cu vârsta, fiind de aproximativ 10% la persoanele sub 30 ani şi de egală cu vârsta la persoanele peste 60 ani.
Contaminarea se face pe cale fecal-orală, direct de la om la om (bolnavii sau putătorii cronici excretă bacteria prin vărsături, salivă, fecale) sau prin consum de apă infectată. Transmiterea bacteriei se face în special în copilărie, interfamilial. Infecţia cu HP este cronică şi nu se vindecă spontan (în copilărie se poate întâmpla ca infecţia să fie eliminată ca urmare a tratamentelor antibiotice pentru alte afecţiuni).
Omul se poate infecta şi cu Helicobacter heilmannii, o tulpină izolată la animale (câini, pisici, porci, primate) dar cu o prevalenţă de doar 0,5%.
Statistici despre Helicobacter pylori
- descoperirea sa a fost recompensată cu Premiul Nobel pentru Medicină şi Fiziologie în anul 2005
- 95% dintre pacienţii cu ulcer duodenal* şi 75-85% dintre pacienţii cu ulcer gastric* prezintă infecţie cu HP
- doar 15-20% dintre persoanele infectate cu HP vor dezvolta ulcer pe parcursul vieţii
- după eradicarea infecţiei cu HP, rata de recidivă a ulcerului în primul an este sub 10% (în absenţa tratamentului antibiotic antiHP, rata recidivelor este de 70-80%)
*excluzând ulcerul post-AINS
Istoric
În 1875, un grup de savanţi germeni au identificat pentru prima oară bacteria, însă nu au reuşit să o cultive în laborator. În 1889, profesorul polonez Walery Jaworski a identificat în sedimentele rezultate în urma spălăturilor gastrice o bacterie cu formă caracteristică de helix – pe care o denumeşte Vibrio regula. În anii 1980, Robin Warren şi Barry Marshall au reuşitc să izoleze bacteria de la nivelul stomacului şi să o cultive în medii de cultură. Ulterior, deşi ipoteza lor (că ar exista un microorganism care să supravieţuiască în mediul gastric acid şi care să mai provoace şi ulcer) fusese primită cu scepticism din partea lumii medicale, cei doi cercetători australieni au demonstrat faptul că bacteria este responsabilă de majoritatea ulcerelor gastrice şi au spulberat teoria că boala ar fi cauzată de aciditate crescută, condimente sau stress. Pentru a dovedi că HP este într-adevăr responsabil de apariţia gastritei (care poate evolua către ulcer), Marshall a înghiţit o cultură de bacterii; la interval de o săptămână al a dezvoltat simptome de gastrită acută şi biopsiile au evidenţiat atât prezenţa bacteriei, cât şi a gastritei. Actualmente, datorită descoperii celor doi cercetători australieni, 80% dintre pacienţii cu ulcer pot fi vindecaţi definitiv prin eradicarea infecţiei cu HP.
Descriere microbiologică
Helicobacter pylori este un bacil Gram negativ scurt (0,2-0,5 A lungime), spiralat, microaerofil, care determină gastrită cronică şi ulcer gastroduodenal. Bacteria colonizează stomacul, stabilindu-se în mucusul de la suprafaţa mucoasei gastrice şi de la nivelul polului apical al celulelor epiteliale (fără a invada însă mucoasa). Bacteria produce o enzimă – urează – care hidrolizează ureea în amoniac şi dioxid de carbon; produşii hidrolozei ureei vor creşte astfel pH-ul gastric (protejând bacteria de efectele secreţiei clorhidropeptice) şi vor augmenta colonizarea gastrică (apărând astfel un cerc vicios în care numărul de bacterii creşte pe măsură ce se produce din ce în ce mai multă urează şi se alcalinizează mediul gastric). Catalizarea acestei reacţii biochimice are efecte importante asupra funcţiei secretorii gastrice (în fapt acesta este mecanismul prin care se produce ulcerul): alcalinizarea mediului gastric duce la suprastimularea şi hiperplazia celulelor parietale (oxintice) şi la creşterea cantităţii de secreţie gastrică; în timp se produce o dublare a populaţiei de celule parietale, care secretă o cantitate excesivă de acid clorhidric. Totodată, în urma reacţiei apei cu amoniacul pot rezulta ioni hidroxil, care lezează mucoasa gastrică. Proteinele de suprafaţă ale bacteriei sunt chemotactice pentru PMN şi monocite, care vor declanşa o reacţie inflamatorie cu eliberare locală de TNF-alfa, proteaze şi fosfolipaze; efectul acestor enzime va fi degradarea complexului glicoprotein-lipidic al stratului de mucus.
Prezenţa HP poate fi obiectivată fie prin metode invazive (examen histologic, cultură sau detectarea activităţii ureazei în biopsiile de mucoasă gastrică), fie prin metode neinvazive (testul respirator cu uree, dozarea anticorpilor anti-HP). HP se evidenţiază bine în preparatele histologice colorate Giemsa şi mai slab pe cele colorate cu hematoxilină.
Patogenia infecției cu Helicobacter pylori
După ingestie, HP ajunge la nivel gastric şi pătrunde în stratul mucos. Producţia de urează îi asigură supravieţuirea în mediu acid, iar motilitatea este importantă pentru colonizare. Tulpinile de HP au o virulenţă variată, însă au fost grupate în două tipuri, în funcţie de expresia toxinei vacuolizante (VacA) şi citotoxinei asociate (CagA): tipul I – mai agresive (VacA+, CagA+) şi tipul II – mai puţin agresive (VacA-, CagA-).
Prin intermediul antigenelor de suprafaţă, HP atrage polimorfonucleare şi monocite, care vor declanşa o reacţie inflamatorie locală. Inflamaţia este continuă, cronică, iar răspunsul imun la care participă LT, LB, macrofage şi plasmocite este ineficient – ducând astfel la o lezare a stratului epitelial. Totodată, legarea HP de moleculele MHC II de la suprafaţa celulelor epiteliale poate induce apoptoza acestora.
Aspecte clinice ale infecției cu Helicobacter pylori
Infecţia cu HP este de obicei asimptomatică, însă toate persoanele infectate au de obicei leziuni inflamatorii gastrice (gastrită). Atunci când se însoţeşte de manifestări clinice, pacienţii prezintă un sindrom dispeptic: greaţă, vărsături, pirozis, regurgitaţii, disconfort abdominal, dureri abdominale, senzaţie de plenitudine postprandială.
Distribuţia leziunilor de gastrită este în strânsă corelaţie cu riscul de ulcer: astfel, pacienţii cu gastrită antrală (tip B – cea mai frecventă formă de gastrită HP+) sunt predispuşi la ulcere duodenale, iar cei cu gastrită la nivelul corpului şi fundusului gastric asociată cu atrofie focală (tipul A de gastrită cronică) sunt predispuşi la ulcere gastrice, metaplazie intestinală şi în evoluţie, la adenocarcinom gastric. Leziunile atrofice pot apărea ca urmare a răspunsului imun umoral sistemic, care poate genera anticorpi antoimuni împotriva ATP-azei H/K din celulele parietale gastrice.
Infecţia cu HP este responsabilă pentru majoritatea ulcerelor gastrice şi duodenale. Totodată, HP a fost dovedit a fi un important factor de risc pentru adenocarcinoamele gastrice (cu excepţia celor cardiale); astfel, riscul de ADK la un pacient cu infecţie HP+ este crescut de 9 ori. Conform clasificării IARC (International Agency for Research on Cancer) HP este încadrat în grupa I de carcinogeni (efectul carcinogen fiind demonstrat prin studii epidemiologice caz-martor).
Infecţia cu HP creşte semnificativ şi riscul de limfom gastric MALT (mucosa-associated lymphoid tissue); circa 72-98% dintre pacienţii cu limfom MALT sunt HP+, iar eradicarea infecţiei induce regresia la circa 70-80% din cazuri.
Rolul infecţiei cu HP la pacienţii cu dispepsie non-ulceroasă este controversat; unele studii (dar nu toate) au arătat o ameliorare a simptomatologiei după antibioterapie la o parte dintre pacienţi, sugerând că ar exista şi alte mecanisme ale acestei afecţiuni.
Eradicarea infecţiei cu HP este importantă şi la pacienţii cu boală de reflux gastroesofagian. Actualmente se studiază implicarea bacteriei în boli extragastrice.
Metode de diagnostic ale infecției cu Helicobacter pylori
- 1. Teste invazive (necesită efectuarea endoscopiei şi prelevare de biopsii)
- testul bioptic al ureazei: se practică EDS cu anestezie** orofaringiană, se prelevează mai multe biopsii care se introduc într-un gel care conţine uree şi un indicator. Virarea culorii (care are loc în 20 minute-24 ore) relevă prezenţa ureazei, şi deci a infecţiei HP. Testul are o sensibilitate de 80-100% şi o specificitate de 92-100%.
- testul histologic: permite evidenţierea directă a HP prin folosirea de coloraţii speciale (Giemsa modificată) şi poate oferi informaţii şi despre epiteliul gastric (atrofie, metaplazie).
- cultura HP: are cea mai înaltă specificitate, dar o sensibilitate scăzută, datorită dificultăţii izolării HP. Cultura HP cu efectuarea antibiogramei nu se face de rutină pentru diagnostic, ci mai ales după un eşec terapeutic.
- **anestezia poate declanşa gust amar, senzaţie de amorţeală sau tumefiere la nivelul limbii şi orofaringelui, senzaţie de lipsă de aer, greaţă. Comunicarea cu pacientul se va face prin semne stabilite înaintea procedurii sau explicate instant de către medic.
2. Teste non-invazive
- testul serologic (testul anticorpilor serici) – constă în determinarea titrului de anticorpi antiHP de tip IgG. Se recoltează sânge venos de la nivelul unei vene periferice a braţului şi se dozează anticorpii specifici prin ELISA. Testul se poate repeta la 6 luni după tratament, şi dacă este negativ indică eradicarea infecţiei; nu se repetă mai devreme pentru că titrul anticorpilor scade lent.
- testul respirator cu uree: pacientul este invitat să bea o soluţie de uree marcată radioactiv cu C13 sau C14 şi apoi este rugat să sufle într-un tub, pentru a măsura dioxidul de carbon radioactiv în aerul expirat. Prezenţa infecţiei se confirmă pe baza producţiei de urează, cu eliberare de CO2 marcat. Testul este indicat pentru diagnosticul iniţial al infecţiei şi pentru evaluarea terapiei chiar la 1 lună de la tratament. Expunerea radioactivă este mai mică decât la o radiografie toracică şi similar cu cel al expunerii zilnice la radiaţiile ultraviolete.
- testul antigenului la nivelul materiilor fecale: se recoltează o mostră de materii fecale şi se determină antigenul HP. Testul are o sensibilitate de 88-89% şi o specificitate de peste 90%. Este preferată la copiii mici, care nu înţeleg protocolul testului respirator cu uree.
- teste moleculare: constau în identificarea ADN-ului HP în diverse probe biologice. Se poate practica PCR din fragmente bioptice, salivă, suc gastric, materii fecale.
Medicina bazată pe dovezi
O meta-analiză din 2002 a acurateţei diverselor teste diagnostice pentru HP la pacienţii cu HDS a concluzionat că testele bazate pe metode bioptice (testul rapid cu urează, testul histologic şi cultura HP) au o sensibilitate scăzută, dar o specificitate înaltă. Acurateţea testului respirator cu uree rămâne foarte bună, spre deosebire de cea a antigenului din materiile fecale.
Alegerea tipului de test pentru depistarea infecţiei cu HP trebuie să ţină cont de cost, disponibilitate, context clinic, prevalenţa în populaţie a infecţiei (probabilitatea pretest) şi alţi factori care ar putea influenţa rezultatul (tratament cu IPP sau antibiotice).
Pentru ulcerele duodenale necomplicate (care sunt majoritatea HP+, în special după excluderea AINS) s-a considerat iniţial că nu este necesară nicio metodă diagnostică şi că tratamentul ar trebui să fie empiric; totuşi, infecţia cu HP este absentă la 27% dintre pacienţii la care endoscopic s-a identificat un ulcer duodenal (această categorie de pacienţi are şi un prognostic mai prost).
Tratamentul infecției cu Helicobacter pylori
Obiectivul tratamentului este eradicarea completă a bacteriei din organism. După antibioterapie, rata reinfecţiei este mică. Schemele terapeutice standardizate au o eficacitate de cel puţin 90%. Tratamentul antibiotic nu se administrează singur, ci în combinaţie cu antisecretorii, deoarece eficienţa anumitor agenţi antimicrobieni activi pe HP depinde de aciditatea mediului gastric.
Nu se administrează niciodată monoterapie, deoarece riscul dezvoltării rezistenţei este mare (cel mai frecvent apare rezistenţă la metronidazol, apoi la claritromicină şi mai rar la amoxicilină). Principalii agenţi antiHP sunt: amoxicilina, claritromicina, metronidazolul, tetraciclina şi bismutul. Ca antisecretorii se folosesc fie inhibitorii de pompă protonică, fie blocantele H2.
A fost dezvoltat şi un vaccin cu viză profilactică şi terapeutică, care s-a dovedit eficient la animalele de laborator însă imunizarea la om rămâne dificilă deoarece imunologia stomacului este puţin elucidată.
Scheme terapeutice
Dubla terapie: claritromicină (500 mg x 3/zi) + omeprazol (40 mg/zi) sau claritromicină (500 mg x3/zi) + ranitidină bismut citrat (400 mg x2/zi), timp de 14 zile.
Tripla terapie: IPP în 2 prize zilnice (sau ranitidină bismut citrat) + claritromicină (500 mg x2/zi) + metronidazol (500 mg x2/zi) sau amoxicilină (1g de 2 ori/zi).
Cvadrupla terapie: IPP în 2 prize zilnice + bismut subtitrat coloidal (120 mg x 4/zi) + metronidazol (500 mg x3/zi) + tetraciclină (500 mgx4/zi).
În caz de eşec terapeutic, se efectuează culturi şi antibiogramă. Reinfecţia după eradicare este de 1%. Succesul eradicării se evaluează prin EDS la ulcerul gastric şi prin testul respirator la uree la ulcerul duodenal.
Indicaţiile tratamentului antiHP (Grupul European pentru Studiul Helicobacter Pylori, Maastricht, 2000)
- toţi pacienţii cu UG/UD, inclusiv formele cu complicaţii
- pacienţii cu limfom MALT
- după rezecţie pentru cancer gastric
- pacienţi cu gastrită atrofică
- pacienţi cu antecedente heredocolaterale de cancer gastric
Eradicarea infecţiei HP este recomandată (dar nu obligatorie) şi la:
- bolnavii cu dispepsie funcţională
- bolnavii cu boală de reflux gastroesofagian
- pacienţi care necesită tratament de lungă durată cu AINS
Concluzii
Descoperirea Helicobacter pylori în anii 1980 ca agent cauzal al bolii ulceroase a revoluţionat diagnosticul şi tratamentul acestei afecţiuni. Infecţia este principala cauză de gastrită cronică, ulcer peptic şi limfom MALT. În ţările dezvoltate, epidemiologia infecţiei cu HP se caracterizează printr-o creştere liniară odată cu înaintarea în vârstă; în ţările în curs de dezvoltare (inclusiv România), se constată un număr semnificativ de infecţii şi în rândul copiilor şi adolescenţilor. Principalul rezervor de infecţie sunt persoanele HP+, iar calea de transmitere dominantă este contactul interuman, prin folosirea în comun a obiectelor personale.
Principalele elemente care au evidenţiat rolul cauzal al infecţiei cu HP în boala ulceroasă au fost:
- prezenţa infecţiei este factor de risc pentru dezvoltarea ulcerului
- de obicei, ulcerele nu apar în absenţa infecţiei (cu excepţia ulcerelor în care există alţi factori etiologici – ex. ulcerele post-AINS)
- vindecarea infecţiei duce la o scădere foarte mare a ratei recurenţelor (de la 80% în absenţa tratamentului antiHP până la 15% în prezenţa tratamentului)
- inducerea experimentală a infecţiei la animale de laborator produce leziuni gastrointestinale

