Boala trofoblastic? gesta?ional? grupeaz? o serie de tumori placentare: benigne (mola hidatiform? – complet? ?i par?ial?) ?i maligne – neoplazii trofoblastice gesta?ionale (mola invaziv?, remedy here coriocarcinomul, tumora trofoblastic? epitelioid?).
Mola hidatiformă sau sarcina molară este cea mai frecventă formă de boală trofoblastică gestațională, reprezentând circa 80% din cazuri; restul 10-15% sunt reprezentate de mola invazivă și 2-5% de coriocarcinom.
Mola hidatiformă (sarcina molară)
Sarcina molară se caracterizează histologic prin anomalii ale vilozităților coriale constând în proliferare trofoblastică și edem al stromei viloase. Deși este de obicei localizată în cavitatea uterină, mola se poate dezvolta și ca o sarcină ectopică. Histologic, mola este derivată din masa celulară externă a blastocistului. Caracteristica molei este producția crescută de hCG de către masa trofoblastică.
În funcție de modificările histologice, prezența sau absența elementelor embrionare/fetale și cariotip, mola poate fi:
- parțială – cariotip triploid (69 XXX, 69 XXY, rareori 69 XYY), făt prezent, amnion prezent, edem vilos focal, proliferare trofoblastică focală ușoară-moderată, prezentare clinică ca avort, uter de mărime mică pentru durata amenoreei, asociere în 1-5% din cazuri cu boală trofoblastică persistentă.
- completă – cariotip diploid (85% 46 XX de origine paternă, 15% 46 XY), făt absent, amnion absent, edem vilos difuz, vilozități avasculare, proliferare trofoblastică moderat-severă, prezentare clinică ca sarcină molară, uter de mărime normală/crescută pentru vârsta gestațională, complicații medicale frecvente, prezența de chisturi luteale, asociere în 15-20% din cazuri cu boală trofoblastică persistentă
Sarcina molară poate fi unică sau poate coexista într-o sarcină multiplă cu feți sănătoși. Într-o sarcină gemelară, viabilitatea fătului normal depinde de diagnosticarea corectă a molei coexistente și a posibilelor complicații asociate acesteia (preeclampsie, hemoragie). Femeia cu sarcină multiplă care include o molă prezintă un risc crescut de boală trofoblastică persistentă.
Incidența molei hidatiforme este de 1-2:1000 sarcini. Sarcina molară este mai frecventă la hispanici, amerindieni și asiatici. Factorii de risc pentru mola hidatiformă sunt: vârsta maternă sub 18 sau peste 35 ani, vârsta paternă înaintată, status socioeconomic scăzut, istoric de sarcină molară (risc de recurență), carență nutrițională în proteine, deficit de acid acid folic sau alte vitamine, avorturi în antecedente, consumul de contraceptive orale, fumatul. Femeile cu vârstă între 36 și 40 ani prezintă un risc dublu de sarcină molară, iar cele peste 40 ani un risc de 10 ori crescut față de femeile sub 35 ani.
Manifestările clinice sunt similare unei sarcini ectopice. În general, simptomatologia este mai pronunțată în cazul molei complete și constă în: amenoree de 1-2 luni, greață, vărsături, sângerări uterine, anemie feriprivă, mărire disproporționată a uterului (creștere exagerată raportată la vârsta gestațională la 50% dintre femei și uter mic pentru vârsta gestațională la 1/3 dintre femei), preeclampsie cu debut precoce (în mod normal, hipertensiunea indusă de sarcină apare după 24 săptămâni; creșterile tensionale în primul trimestru sau începutul trimestrului 2 sunt înalt sugestive pentru sarcina molară), hipertiroidism (datorită efectului TSH-like al hCG), chisturi ovariene luteale (cele de dimensiuni mari sunt dureroase, se pot torsiona, infarctiza sau pot sângera). Netratată, expulzia spontană a țesutului molar apare în jurul vârstei de 16 săptămâni.
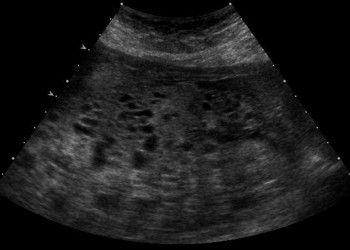
Paraclinic, nivelul beta-hCG este crescut în sânge și ser (de ordinul a zeci sau sute de mii mUI/ml în ser și peste 1.000.000 UI/24 ore în urină), ecografia evidențiază uter ecogen cu numeroase spații chistice, absența embrionului sau a sacului amniotic (aspect de “fulgi de zăpadă” sau “ciorchine de strugure”) și chisturi ovariene. Pentru cariotipare se poate efectua amniocenteză sau biopsie de vilozități coriale. Investigațiile imagistice (radiografie, CT) sunt recomandate pentru depistarea metastazelor trofoblastice (în ficat, plămâni, creier, rinichi). Se va efectua și coagulogramă datorită riscului de coagulare intravasculare diseminată.
Diagnosticul diferențial trebuie făcut cu o sarcină multiplă, un leiomiom uterin sau o polifibromatoză uterină.
Tratamentul constă în evacuarea molei prin chiuretaj aspirativ, sub perfuzie de oxitocină. După evacuare se face controlul cavității uterine cu chiureta și evaluare ecografică pentru a verifica golirea cavității uterine. Rareori se recurge la inducerea travaliului sau histerotomie. La femeile cu vârstă avansată, care nu mai doresc copii, se poate practica histerectomie (procedura fiind asociată cu un risc mai mic de boală trofoblastică persistentă). Post-evacuare, unii autori recomandă chimioterapie profilactică cu actinomicină sau metotrexat. În momentul evacuării molei, mase de celule trofoblastice pot intra în sistemul venos pelvin și metastaza în parenchimul pulmonar; embolizarea trofoblastică poate duce la embolie pulmonară clinic aparentă sau edem pulmonar acut.
După evacuarea sarcinii molare trebuie începută o supraveghere atentă a titrului hCG pentru depistarea persistenței bolii trofoblastice: săptămânal până când devine nedetectabil (uzual 7-9 săptămâni), apoi lunar timp de 6-12 luni. Un nivel crescut al hCG după evacuarea molei este marker de boală trofoblastică persistentă. Pe durata supravegherii de 6-12 luni, femeia va fi sfătuită să apeleze la contracepție (anticoncepționale orale).
Boala trofoblastică gestațională malignă
Neoplazia trofoblastică gestațională cuprinde tumorile trofoblastice care invadează miometrul și metastazează: mola invazivă, coriocarcinomul, tumora trofoblastică epitelioidă, tumora trofoblastică placentară.
Boala trofoblastică gestațională malignă este diagnosticată pe baza persistenței post-molare a valorilor crescute de hCG sau pe analiza histopatologică. Neoplazia apare întotdeauna sau urmează unei forme de sarcină – în cele mai multe cazuri se dezvoltă după o sarcină molară, dar poate apărea și după un avort, o sarcină normală sau una ectopică.
Mola invazivă este o proliferare trofoblastică excesivă cu invazie în miometru și chiar parametru sau vagin. Invazia miometrială duce la sângerări vaginale repetate și neregulate, ceea ce domină tabloul clinic al molei invazive. Deși este foarte agresivă din punct de vedere al invazivității locale, este în general lipsită de tendința pronunțată de metastazare caracteristică coriocarcinomului.
Tumora trofoblastică placentară se dezvoltă din locul de inserție al placentei după o sarcină normală, un avort spontan sau indus, o sarcină ectopică sau molară. Din punct de vedere histologic, tumora prezintă celule trofoblastice intermediare care secretă prolactină, motiv pentru care nivelul hCG este relativ redus raportat la masa tumorală. Caracteristic tumorii trofoblastice placentare este proporția crescută (peste 30%) de free-hCG. Tumorile invazive local sunt chimio-rezistente și necesită sancțiune chirurgicală prin histerectomie.
Tumora trofoblastică epitelioidă este similară din punct de vedere histologic cu tumora trofoblastică placentară, însă celulele sunt mai mici și au un pleomorfism nuclear redus. În plus, spre deosebire de aspectul infiltrativ al tumorii trofoblastice placentare, cea epitelioidă are un pattern nodular. La nivel mondial au fost raportate doar 52 cazuri până în 2008 (Palmer et al). Tratamentul constă în histerectomie. Circa 25% dintre femeile diagnosticate cu tumoră trofoblastică placentară prezintă boală metastatică.
Coriocarcinomul este o tumoră malignă derivată din epiteliul corionic. Microscopic, tumora este formată din sincițiotrofoblast și citotrofoblast, cu predominența unuia dintre aceste elemente: celulele trofoblastice penetrează stratul muscular și vasele de sânge având fie o dispoziție dezorganizată, fie plexiformă; nu există vilozități. Incidența sa este de 1 la 30.000 sarcini – 2/3 apar după o sarcină normală și 1/3 după o sarcină molară. Clinic, carcinomul se prezintă ca o masă tumorală ce invadează miometrul și pediculii vasculari, ducând la hemoragie și necroză și involuție uterină. Coriocarcinomul prezintă o rată înaltă de metastazare în țesuturile bogat vascularizate (creier, plămâni, ovare, vagin, vulvă, rinichi și ficat) – datorită afinității celulelor trofoblastice pentru vasele sangvine.
Tratamentul constă în monochimioterapie în administrare orală/intraarterială asociată sau nu cu histerectomie la femeile cu neoplazie trofoblastică gestațională non-metastatică sau cu neoplazie metastatică cu risc scăzut (low-risk). Femeile încadrate în categoria de risc crescut (high-risk) la o valoare peste 7 a scorului prognostic OMS trebuie tratate cu polichimioterapie – schema EMA-CO (vindecare 67-85%): etoposid, metotrexat, actinomicin D, ciclofosfamidă, oncovin (vincristin), la care se asociază radioterapie și chirurgie. Chiuretajul repetat trebuie evitat deoarece poate duce la perforarea uterului. Prognosticul depinde de prezența metastazelor hepatice, cerebrale sau pulmonare.
Dacă supravegherea minimă pentru sarcina molară este de 6 luni, pentru neoplazia trofoblastică gestațională se recomandă minim 1 an și pentru neoplaziile metastatice minim 2 ani. Riscul de a dezvolta o boală trofoblastică gestațională la o sarcină ulterioară este de 2%.

